核医学是医学的一个分支,主要利用物质的核特性来进行医学诊断或治疗。医学诊断主要是指成像,即将生物体中放射性核素的分布可视化,主要用于获取较精细的器官或组织解剖细节或功能表象;治疗,或者说是放射治疗(放疗),作为治疗癌症的重要方法之一,利用高能射线辐照来破坏肿瘤。
那么如何利用放射性核素实现成像或者治疗的目的呢?首先我们需要了解一下基本的物理概念:什么是放射性?什么是衰变?
基本物理概念
首先我们从原子讲起。原子由带正电的质子、中性中子和带负电的电子组成。由质子和中子组成的核心区域称为原子核,质子和中子也被称为核子。
核素是一类具有特定质子数和中子数以及能态的原子。我们通常用 ZAX _{Z}^{A}X 来概括某一核素的基本组成,其中 X 是元素的化学符号,A 是质量数或核子数,Z 是质子数。 质子数相同而中子数不同的核素称为同位素。
核素可以是稳定的或不稳定的。大多数自然存在的原子是稳定的。不稳定的核素称为放射性核素,它有一个自发的过程来释放其多余的内能并将其转化为更稳定的核素。 这个过程被称为放射性衰变。根据衰变过程中释放的粒子,衰变模式可分为α衰变、β-衰变、β+衰变、电子俘获、γ衰变和内转换以及极重同位素的自发裂变衰变。此处重点介绍以下几种衰变:
α衰变
核素的α衰变是指衰变过程中释放α粒子( 24He _{2}^{4}He),该衰变容易发生在较重的核素身上(例如222Rn, 225Ac, 226Ra)。该过程可以表示为:
ZAX→Z−2A−4Y+24He _{Z}^{A}X\rightarrow _{Z-2}^{A-4}Y + _{2}^{4}He
β-衰变
β-衰变发生在通过发射电子 ( e−e^{-}) 和反电子中微子 ( v¯e\bar{v}_{e} ) 衰变的放射性核素上。这种衰变模式常发生在中子过剩的核素上,如 67Cu 和 177Lu。β-衰变的反应方程式如下:
ZAX→Z+1AY+e−+v¯e _{Z}^{A}X\rightarrow _{Z+1}^{A}Y + e^{-}+\bar{v}_{e}
β+衰变
β+衰变发生在通过发射正电子 ( e+e^{+} ) 和电子中微子 ( vev_{e}) 衰变的放射性核素上。这种衰变模式常发生在质子过剩的核素上,如18F 和 82Lu。其反应方程式如下:
ZAX→Z−1AY+e++ve _{Z}^{A}X\rightarrow _{Z-1}^{A}Y + e^{+}+{v}_{e}
电子俘获
电子俘获是原子内部轨道中的电子被质子俘获(将质子转化为中子)并同时发射电子中微子的过程。 这种衰变模式与 β+ 衰变处于竞争状态。 电子捕获过程如下:
ZAX+e−→Z−1AY+ve _{Z}^{A}X+ e^{-}\rightarrow _{Z-1}^{A}Y +{v}_{e}
γ衰变和内转换
当α衰变或β衰变产生的子核素处于激发态(核素的能量没有全部带走)时,就会发生γ衰变和内转换。 为了达到基态,不稳定的核子要么通过发射一个或多个光子(γ 衰变)来发射激发能,要么将多余的能量直接转移到它们自己的轨道电子之一并从原子发射电子(内部转换)。 γ衰变和内转换过程分别如下:
ZAX∗→ZAX+γ _{Z}^{A}X^{*}\rightarrow _{Z}^{A}X + \gamma
ZAX∗→ZAX++e−→ZAX _{Z}^{A}X^{*}\rightarrow _{Z}^{A}X^{+}+e^{-}\rightarrow _{Z}^{A}X
其中 ZAX∗ _{Z}^{A}X^{*} 和 ZAX+ _{Z}^{A}X^{+} 分别是原子核 ZAX _{Z}^{A}X 的激发态和单电离态。
综上,通过衰变,放射性核素发射粒子,这些粒子可以被应用于医学成像和治疗。
医学成像
典型的成像技术是单光子发射计算机断层扫描 (SPECT)和正电子发射断层扫描 (PET)。 与主要提供形态学信息的其他成像技术(例如 CT 或磁共振成像 (MRI))相反,核医学成像提供功能信息。例如,PET成像可以跟踪患者的生化变化和代谢功能,它可用于研究身体机能、确定疾病传播的范围,甚至在出现症状之前检测疾病。
医学成像实质上是对γ射线的应用,因为γ射线的高穿透性使其可以穿过人体在体外被探测器检测到。 这些γ射线要么直接在放射性核素衰变过程中产生(即通过γ衰变),要么通过电子-正电子转换成一对 511 keV 伽马射线而间接产生。在大多数情况下,这些放射性核素附着在载体分子上,形成靶向癌细胞的放射性药物。 在某些特定情况下,放射性核素可以单独使用,例如可以应用于甲状腺诊断的碘。
SPECT成像(单光子发射计算机断层成像)
单光子发射计算机断层扫描 (SPECT) 是一种使用 γ 射线生成人体横截面信息的 2D 或 3D 图像的成像技术。用于 SPECT 成像的所有放射性核素的 γ 射线能量范围必须在 80 keV 和 250 keV 之间,最佳值约为 140 keV。
用于SPECT成像的放射性核素在靶向细胞(目标器官或组织)附近发射γ射线,这些射线会穿透人体并被闪烁体和光子换能器检测到并转换成光信号,之后再由半导体转换成电信号,从而输出层析成像的投影。伽马相机应围绕患者旋转 360°时可以获得 3D SPECT 图像。
用于SPECT成像的主要放射性核素有99mTc(世界上使用最广泛的)、123I、111In、67Ga和201Tl。 最近,155Tb(T1/2 = 5.32 d)因其合适的能量(Eγ = 87 keV(32%)、105 keV(25%))而受到关注。这些放射性核素的衰变信息如表1.1所示。
表1.1 几种可用于SPECT成像的放射性核素衰变特性表。
核素半衰期主要γ 射线能量(keV)强度(%)67Ga3.3 天93.3
184.638.8
21.499mTc6.0 小时140.589111In2.8 天171.3
245.490.7
94.1123I13.2 小时159.083.6201Tl3.0 天167.410.0155Tb5.3 天86.6
105.3
108.132.0
25.1
7.5PET成像(正电子发射断层扫描)
正电子发射断层扫描 (PET) 是一种 3D 成像技术,它基于正电子发射器的放射性示踪剂来可视化和监测器官功能、代谢过程和吸收过程。
当可以发生β+衰变的放射性核素结合受体进入人体之后,核素发射的正电子将通过与身体相互作用而减速,并且当几乎静止时将与生物体中的电子发生反应。 这些电子-正电子对湮灭产生一对几乎背靠背方向发射的能量为 511 keV 的光子。 此时,在患者体外围绕了一圈的闪烁探测器将在同一直线相反方向探测到这两个光子,,同时它们将被记录下来(重合探测)。 每个记录对都允许定义一处响应,然后通过算法重建放射性药物在患者体内的原始分布 。
使用最多的 PET 放射性核素是 18F。同时,一些金属放射性核素也被研究作为 PET 同位素,如 64Cu、68Ga、82Rb 和 89Zr。此外, 152Tb 作为正电子发射体,被认为是一种具有潜力的可用于 PET的放射性核素。这些放射性核素的衰变信息如表 1.2 所示。表1.2中涉及到β+衰变的支化率,支化率是指某一种衰变模式占该放射性核素衰变模式的比例,因为有些放射性核素同时具有多种衰变模式。由表可知,11C、13N、15O和18F的β+衰变的支化率接近100%; 相反,其他放射性核素,尤其是 64Cu、89Zr 和 152Tb,具有较小的支化率(小于 25%)。对于支化率比较低的放射性核素,需要增加注入剂量以收集足够的光子,这可能会增加患者所受的辐射剂量。
表1.2 几种可用于PET成像的放射性核素衰变特性表。
核素半衰期衰变支化率 (%)平均 能量
(MeV)11C20.4 分钟99.80.3913N10.0 分钟99.80.4915O122.2 秒99.90.7418F109.8 分钟96.70.2564Cu12.7 小时17.50.2868Ga67.7 分钟88.90.7482Rb1.3 分钟95.41.4189Zr78.4 小时22.70.39152Tb17.5 小时20.31.14放射治疗
放射治疗是一种使用电离辐射破坏癌细胞的治疗方法。 它通常与手术和/或化疗结合使用。 高能辐射会破坏细胞的 DNA,并阻止它们进一步分裂和增殖。放射治疗的目标是最大限度地提高对异常癌细胞的辐射剂量,同时降低对正常细胞的影响。放射治疗主要有两种类型,体外放射治疗(远距放射治疗或放疗)和体内放射治疗(放射性核素治疗)。 在外部放射治疗中,辐射在患者体外产生(比如由加速器或放射源产生)并被发送到肿瘤部位,而在放射性核素治疗中,大多数情况下,放射性药物(核药)是需要被注射到体内并尽可能接近要破坏的肿瘤的。
体外放射治疗
体外放射治疗会最常用的是辐X 射线、质子束或者碳离子束照射患者肿瘤部位。一些密封源也可用于提供γ射线,如伽玛刀使用的60Co,或发展中国家仍在使用的137Cs。 外照射的优点是无创,效果好; 缺点是在辐射束在到达靶细胞之前会与正常细胞相互作用造成正常细胞的损伤,另外,体外放疗不适用于治疗癌细胞大规模扩散的患者。
体内放射治疗
体内放射治疗,或者说放射性核素治疗,是一种靶向治疗,它利用化学性质或生物学性质将放射性核素引导至靶向细胞(肿瘤),然后通过放射性核素的衰变产生的电离辐射破坏肿瘤。
放射性核素治疗中使用的辐射必须与物质发生强烈相互作用,才能在短距离内传递尽可能多的能量。 这就是为什么要使用带电粒子,例如 α 粒子、β 粒子、俄歇电子或转换电子。 这些粒子中的每一个都具有不同的射程和线性能量转移 (LET) 值,从而导致不同的相对生物有效性。 LET 对应于每单位轨道长度的能量传输速率 (keV/μm);它随着粒子能量的增加而减小。
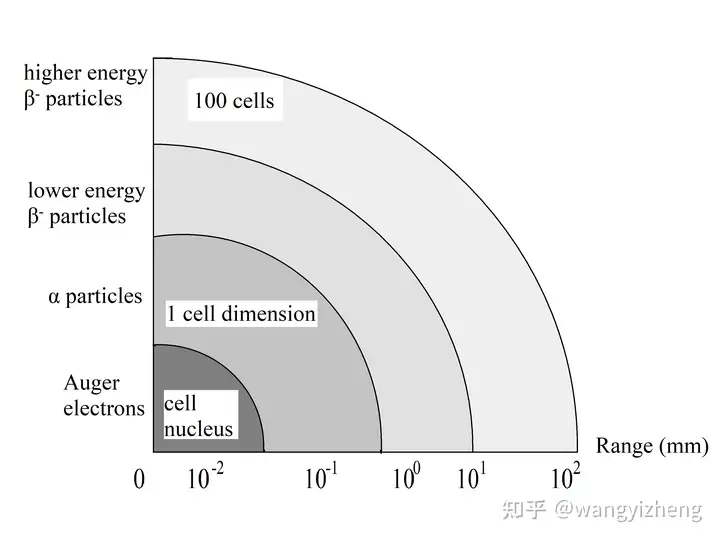
图 1.1 显示了各种类型粒子的范围。 俄歇电子发射器(如 111In 和 123I)具有低能量(10 eV-10 keV),辐射可以高度集中在小体积(细胞核大小)中并通过破坏细胞膜杀死细胞。衰变发射α 粒子的核素能量通常在4-8 MeV,该能量足以破坏癌细胞中DNA的双链结构。其射程范围可达 100 µm,通常为几个细胞大小。发射 β 粒子的放射性核素具有更长的射程(超过 1 毫米)和更低的能量(在大多数情况下小于 1 MeV),通常只能破坏DNA的单链结构。 在这种情况下,可以使用交叉火力技术来产生足够的能量来杀死癌细胞。
Theranostics诊断-治疗一体化
Theranostics这个词是英语里“治疗(therapy)“和”诊断(diagnostics)“的结合,这种诊断-治疗一体化的治疗方法是近几年新兴的一种个性化医疗手段。治疗诊断一体化的主要思想是使用可以应用来自相同元素或具有相似化学性质的元素的一对放射性核素:第一个用于成像,第二个用于治疗,从而确定患者对特定药物的反应跟踪治疗的初始结果,最后为患者个性化和调整治疗。
这个概念最早是在 1990 年代由 Herzog 等人提出的使用 86Y/90Y放射性核素对治疗乳腺癌。相同元素的几种放射性核素组合被认为是治疗诊断学的最佳方案,例如 44gSc/47Sc、64Cu/67Cu、83Sr/89Sr、124I/131I 和 152Tb/161Tb26。 这些组合的特征在于第一种放射性同位素是 β+ 发射体,第二种放射性同位素是 β- 发射体。 这种组合的优点是放射性核素对的化学性质相同,有利于后续的药理研究。 然而,这些放射性核素的生产并未到达商业化的地步,很多核素的供应不足(这部分是我目前的工作方向,欢迎同行交流合作。)
近年来治疗诊断学的概念已经扩展到使用化学相似的核素对来代替供应短缺的核素。 一个典型的例子是 β+ 发射极 68Ga 和 β- 发射极 177Lu的组合。 68Ga主要由68Ge/68Ga发生器或回旋加速器生产,而177Lu(T1/2 = 6.647 d)主要由核反应堆通过核反应176Lu(n,γ)177Lu生产。该核素对目前被证明具有治疗前列腺癌的潜力。
参考文献
1. Khalil, M. Basic Sciences of Nuclear Medicine. (Springer Science & Business Media, 2010).
2. Otuka, N. & Takács, S. Definitions of radioisotope thick target yields. Radiochimica Acta 103, 1–6 (2015).
3. Stephens, K. New PET Tracer Detects Hallmark of Alzheimer’s Disease Years Before Symptoms Emerge. AXIS Imaging News (2021).
4. Naqvi, S. A. R. & Imran, M. B. Medical Isotopes. (BoD – Books on Demand, 2021).
5. Madsen, M. T. Recent Advances in SPECT Imaging. Journal of Nuclear Medicine 48, 661–673 (2007).
6. Qaim, S. M. Nuclear data for production and medical application of radionuclides: Present status and future needs. Nuclear Medicine and Biology 44, 31–49 (2017).
7. Müller, C. et al. Future prospects for SPECT imaging using the radiolanthanide terbium-155 — production and preclinical evaluation in tumor-bearing mice. Nuclear Medicine and Biology 41, e58–e65 (2014).
8. NuDat 3. https://www.nndc.bnl.gov/nudat3/.
9. McQuade, P., Rowland, D. J., Lewis, J. S. & Welch, M. J. Positron-Emitting Isotopes Produced on Biomedical Cyclotrons. Current Medicinal Chemistry 12, 807–818.
10. Kapoor, V., McCook, B. M. & Torok, F. S. An Introduction to PET-CT Imaging. RadioGraphics 24, 523–543 (2004).
11. Turkington, T. G. Introduction to PET Instrumentation. JOURNAL OF NUCLEAR MEDICINE TECHNOLOGY 29, 8 (2001).
12. Deng, X. et al. Chemistry for Positron Emission Tomography: Recent Advances in 11C-, 18F-, 13N-, and 15O-Labeling Reactions. Angewandte Chemie International Edition 58, 2580–2605 (2019).
13. Müller, C. et al. A Unique Matched Quadruplet of Terbium Radioisotopes for PET and SPECT and for α- and β−-Radionuclide Therapy: An In Vivo Proof-of-Concept Study with a New Receptor-Targeted Folate Derivative. Journal of Nuclear Medicine 53, 1951–1959 (2012).
14. Carter, L. M. et al. The Impact of Positron Range on PET Resolution, evaluated with Phantoms and PHITS Monte Carlo Simulations for Conventional and Non-conventional Radionuclides. Mol Imaging Biol 22, 73–84 (2020).
15. Livieratos, L. Technical Pitfalls and Limitations of SPECT/CT. Seminars in Nuclear Medicine 45, 530–540 (2015).
16. Mariani, G. et al. A review on the clinical uses of SPECT/CT. Eur J Nucl Med Mol Imaging 37, 1959–1985 (2010).
17. Beyer, T. et al. A combined PET/CT scanner for clinical oncology. Journal of nuclear medicine 41, 1369–1379 (2000).
18. Dendale, R. et al. [Proton therapy in France in 2019]. Cancer Radiother 23, 617–624 (2019).
19. Pisansky, T. M. External-Beam Radiotherapy for Localized Prostate Cancer. New England Journal of Medicine 355, 1583–1591 (2006).
20. Kassis, A. I. & Adelstein, S. J. Radiobiologic Principles in Radionuclide Therapy. 9.
21. Das, T. & Pillai, M. R. A. Options to meet the future global demand of radionuclides for radionuclide therapy. Nuclear Medicine and Biology 40, 23–32 (2013).
22. Qaim, S. M. Therapeutic radionuclides and nuclear data. Radiochimica Acta 89, 297–304 (2001).
23. Ku, A., Facca, V. J., Cai, Z. & Reilly, R. M. Auger electrons for cancer therapy – a review. EJNMMI Radiopharmacy and Chemistry 4, 27 (2019).
24. Yordanova, A. et al. Theranostics in nuclear medicine practice. onco Targets Ther 10, 4821–4828 (2017).
25. Herzog, H. et al. Measurement of pharmacokinetics of yttrium-86 radiopharmaceuticals with PET and radiation dose calculation of analogous yttrium-90 radiotherapeutics. J Nucl Med 34, 2222–2226 (1993).
26. Qaim, S. M., Scholten, B. & Neumaier, B. New developments in the production of theranostic pairs of radionuclides. J Radioanal Nucl Chem 318, 1493–1509 (2018).
27. Dalm, S. U. et al. 68Ga/177Lu-NeoBOMB1, a Novel Radiolabeled GRPR Antagonist for Theranostic Use in Oncology. Journal of Nuclear Medicine 58, 293–299 (2017).
28. Scarpa, L. et al. The 68Ga/177Lu theragnostic concept in PSMA targeting of castration-resistant prostate cancer: correlation of SUVmax values and absorbed dose estimates. Eur J Nucl Med Mol Imaging 44, 788–800 (2017).


